| Numéro |
OCL
Volume 18, Numéro 2, Mars-Avril 2011
Dossier : Vitamines liposolubles
|
|
|---|---|---|
| Page(s) | 59 - 67 | |
| Section | Nutrition – Santé | |
| DOI | https://doi.org/10.1051/ocl.2011.0376 | |
| Publié en ligne | 15 mars 2011 | |
Les interactions entre les vitamines A, D, E et K : synergie et/ou compétition
Centre hospitalier universitaire de Dijon, Plateau technique de biologie, 2 rue Angélique Ducoudray, BP 37013, 21070 Dijon cedex
*
jean-claude.guilland@wanadoo.fr
Abstract
Antagonist or synergistic interactions have been shown between vitamins A, D, E and K on their respective intestinal absorption (i.e. for vitamins A and E), metabolism (i.e. for vitamins E and K) and biological effects (i.e. for vitamins A and D). Studies have variously indicated antagonistic, additive or synergistic effects of vitamin A in combination with vitamin D, occurring during hormonal ligand binding to their respective nuclear receptors and at multiple steps in cell. In vitro experimental studies have demonstrated that vitamins C and E, the main dietary antioxidants, can interact positively, and this has been confirmed as occurring in vivo. The putative interaction may be direct, via vitamin C ‘‘sparing’’ of vitamin E. However, the antioxidant effects of these two vitamins may operate within the context of an integrating system relying on many other vitamins and nutrients such as b-carotene, lipoic acid and ubiquinol. Any alteration, therefore, in the status of a single vitamin or nutrient could affect the status of other vitamin(s). It also appears that randomized trials aimed to investigate the protective effects of these nutrients by using supplements could not take in account the complexity of these interactions. Vitamin E interacts negatively with vitamin K. The mechanisms by which vitamin E interferes with vitamin K activity, especially blood clotting, are not known. The interference may involve metabolic pathways. Vitamin E may compete for the yet undiscovered enzyme involved in the conversion of phylloquinone (K1) to menaquinone 4 (MK-4, the most potent extrahepatic tissue vitamin K). Vitamin E competes with K1 for the hypothetical cytochrome P450 enzyme that v-hydroxylates the K1 side chain, thereby preventing its b-oxidation and its removal for MK-4 formation. Finally, vitamin E increases xenobiotic pathways that increase hepatic metabolism and excretion of all vitamin K forms.
Key words: vitamin A / vitamin D / vitamin E / vitamin K / antagonistic effects / additive effects / synergistic effects
© John Libbey Eurotext 2011
Aucun facteur vitaminique ne peut être considéré isolément. En effet, l’activité de la plupart des vitamines dépend souvent d’un ou plusieurs autres nutriments (vitamines, minéraux et oligo-éléments). Les interactions vitaminiques peuvent s’exercer au niveau de l’absorption intestinale, du métabolisme et des mécanismes d’action des vitamines. Une vitamine peut se substituer dans une certaine mesure à une autre vitamine, agir favorablement sur la survie, la croissance, la gestation ou les signes biologiques et cliniques d’une avitaminose. Ces interrelations bénéfiques, regroupées sous le terme de « vicariance », ont été bien documentées chez les animaux d’expérience. C’est ainsi que l’apparition des symptômes du scorbut est retardée chez le cobaye par administration de vitamine A. À l’opposé, les interrelations vitaminiques peuvent avoir un effet néfaste. Une surcharge en une vitamine peut entraîner des perturbations variées, aggraver voire susciter une carence en un autre facteur vitaminique. C’est ainsi qu’à forte dose, la niacine, la choline et l’acide folique accentuent l’avitaminose B1 et que la carence en vitamine C s’aggrave lors d’une surcharge en vitamine A. Ces données soulignent la complexité des interactions vitaminiques et permettent de dégager deux considérations générales. L’action d’une vitamine ne peut être considérée sans prendre en compte les interactions possibles existant entre celle-ci et d’autres vitamines ou nutriments. Ces interactions font aussi apparaître la difficulté rencontrée pour fixer la grandeur du besoin en une vitamine – celui-ci étant conditionné, en partie au moins, par le degré d’abondance d’autres vitamines ou nutriments. Dans le cas des vitamines liposolubles (A, D, E et K), des interactions ont été mises en évidence entre la vitamine A et la vitamine D ou la vitamine E, entre la vitamine E et la vitamine C ou la vitamine K.
Les interactions vitaminiques se traduisent soit par des effets additifs, soit par des effets synergiques, soit par des effets antagonistes (figure 1). Dans le premier cas, l’interaction des deux vitamines résulte en l’addition de l’effet de chacune des deux vitamines tandis que dans le deuxième cas, l’interaction résulte en un effet supérieur à la somme des effets produits par chaque vitamine. Dans le troisième cas, la somme des effets est inférieure à l’effet propre de chaque vitamine. Les interactions entre les vitamines anti-oxydantes (C et E) et le β-carotène ont fait l’objet de nombreuses études afin d’évaluer le potentiel protecteur de chacun de ces composés ou de leur association vis-à-vis des pathologies dégénératives. C’est ainsi que les expériences de Shklar et al. (1993) sur le cancer de l’abajoue de hamster sont particulièrement intéressantes, car le cancer développé expérimentalement chez ces animaux est en tout point comparable au cancer naturel. Ces auteurs n’observent pas de régression des tumeurs induites si le β-carotène ou la vitamine E sont administrés isolément. En revanche, lorsque le β-carotène et la vitamine E sont administrés en même temps, les tumeurs induites par l’administration locale de diméthylbenzanthracène (DMBA), un initiateur tumoral, régressent totalement.
 |
Figure 1. Représentation schématique d’un effet additif et d’un effet synergique. |
Interactions entre les vitamines A et D
Les interactions entre la vitamine A et la vitamine D sont complexes. L’acide rétinoïque tout-trans (AR-tt) et l’acide rétinoïque 9-cis (AR 9-cis), les formes actives de la vitamine A, et la 1,25(OH)2 vitamine D3, exercent leurs effets biologiques en se liant à des récepteurs nucléaires spécifiques : le vitamin D receptor (VDR) pour la 1,25(OH)2D3 ; les récepteurs de l’acide rétinoïque (RAR-α, -β et -γ), qui sont activés par l’AR-tt et l’AR 9-cis ; les récepteurs du rétinoïde X (RXR-α, -β et -γ), qui lient l’AR 9-cis. Ces récepteurs se lient à des éléments de réponse sous la forme d’hétérodimères avec RXR (RAR-RXR et VDR-RXR). L’élément de réponse à la vitamine D (VDRE) fixe l’hétérodimère RXR-VDR et l’élément de réponse à l’acide rétinoïque se lie à RXR-RAR. Le ligand spécifique des récepteurs RXR, l’AR 9-cis, peut donc moduler l’action de 1,25(OH)2D3. Les études sur les effets de l’AR 9-cis en combinaison avec 1,25(OH)2D3 ont indiqué des effets antagonistes, additifs ou synergiques (tableau 1). Le contrôle de la production de l’ostéocalcine chez le rat est un exemple illustrant comment la vitamine A module l’expression de gènes induit par la 1,25(OH)2D3. L’AR 9-cis atténue la capacité de 1,25(OH)2D3 à induire une accumulation de l’ARNm qui code l’ostéocalcine, la liaison de l’hétérodimère au VDRE et la transcription à partir d’une construction VDRE-gène reporter. L’antagonisme exercé par l’AR 9-cis dans le système ostéocalcine chez le rat peut aussi mettre en jeu un mécanisme de « détournement » du RXR, du fait des concentrations élevées de cet agoniste, pouvant induire une diminution de la disponibilité de RXR (Mac Donald et al., 1993). Les effets additifs ou synergiques de AR 9-cis vis-à-vis de 1,25(OH)2D3 dépendent de mécanismes transcriptionnels et post-transcriptionnels complexes. Ces effets synergiques sont observés dans de nombreux systèmes cellulaires. C’est ainsi que l’AR 9-cis et la 1,25(OH)2D3 exercent un effet inhibiteur sur la croissance et un effet potentialisateur sur la différenciation de cellules cancéreuses, que ce soient les cellules de carcinome pancréatique humain (Zugmaier et al., 1996) ou de carcinome de côlon humain (Kane et al., 1996), les kératinocytes (Segaert et al., 1997).
Effets de l’acide 9-cis rétinoïque sur la prolifération et la différenciation cellulaires, l’accumulation d’ARNm spécifiques et la transactivation par l’hétérodimère VDR-RXR.
L’AR-9-cis peut aussi moduler l’activité de la vitamine D3 et de ses analogues synthétiques en régulant différentes étapes de la transcription et l’expression de gènes impliqués dans le métabolisme de cette vitamine. La forme circulante majeure de la vitamine D, la 25(OH) D est liée à la vitamin D-binding protein (DBP). Avant d’être activée en 1,25(OH)2 vitamine D dans le rein, le complexe 25(OH) vitamine D/DBP est internalisé dans un premier temps par endocytose médiée par un récepteur composé de la mégaline et de la cubiline. La presque totalité de la 1,25(OH)2 D3 étant liée à la DBP (> 99 %), l’endocytose récepteur-dépendante de ce complexe est essentielle à sa capture cellulaire D et à ses actions biologiques. En fait, plusieurs études récentes montrent que de nombreux épithéliums, dont l’épithélium de la thyroïde, des organes reproducteurs, du sein et de la prostate, expriment ce complexe. L’expression de ce complexe dans les cellules T-47D de cancer du sein humain est modulée par l’AR-tt (Chlon et al., 2008). Il apparaît donc que la vitamine A peut moduler le métabolisme de la vitamine D dans ces cellules.
Interactions entre les vitamines A et E
Les interactions entre les vitamines A et E ont été principalement étudiées chez les animaux de laboratoire et les animaux d’élevage. Chez le rat carencé en vitamine A, les symptômes oculaires tels que la xérophtalmie se développent plus rapidement lorsque les réserves de vitamine E sont faibles (McLaren, 1959). Les mécanismes par lesquels la vitamine E épargne la vitamine A incluent : une protection de la vitamine A de l’oxydation dans la lumière intestinale ; une augmentation de l’absorption intestinale de la vitamine A ; une augmentation du stockage de la vitamine A. Une relation entre le niveau des réserves de vitamine A et la teneur du régime en vitamine E a été établie par plusieurs auteurs. Dès 1940, Moore montre que les rats qui reçoivent un régime contenant de la vitamine E ont une teneur de vitamine A dans le foie 10 fois plus importante que celle des animaux consommant un régime sans vitamine E (Moore, 1940). De plus, les stocks hépatiques de vitamine A de rats carencés en vitamine A diminuent plus rapidement lorsque les animaux consomment un régime carencé en vitamine E que lorsqu’ils consomment un régime contenant de la vitamine E.
Chez le poulet, des apports élevés de vitamine A (100 fois les apports conseillés) interfèrent avec l’absorption de la vitamine E (Sklan et Donoghue, 1982) et sont associés à une diminution très significative de la concentration sérique de l’α-tocophérol (Abawi et Sullivan, 1989). Chez le porc, l’effet de la consommation de doses très élevées de vitamine A (15 fois les apports conseillés) sur la concentration sérique de l’α-tocophérol n’est pas observé (Anderson et al., 1995). Chez l’homme, les résultats des études qui ont investigué les effets de l’administration de β-carotène, seul ou associé à la vitamine A, sur le statut en vitamine E sont discordants. Une « supplémentation » par des doses de β-carotène égales à 15, 30, 45 et 60 mg pendant 9 mois induit une diminution progressive des concentrations sériques de l’α-tocophérol (Xu et al., 1992) tandis que l’administration de β-carotène n’a pas d’effet sur les concentrations sériques d’α-tocophérol pour d’autres auteurs (Albanes et al., 1992 ; Nierenberg et al., 1994 ; Willett et al., 1983). Enfin, l’administration de vitamine A (25 000 UI/j) associée au β-carotène (30 mg/j) pendant six ans induit une augmentation faible mais significative de la concentration sérique de l’α-tocophérol (Goodman et al., 1994). Les discordances entre ces différentes études peuvent être dues à de nombreux facteurs dont le statut vitaminique A et E des sujets étudiés, les doses utilisées et la durée de l’étude. Les résultats obtenus chez les animaux de laboratoire ne peuvent être transposés à l’homme : les doses utilisées étaient très élevées ; le métabolisme de la vitamine A et du β-carotène n’est pas comparable chez l’homme et chez les animaux de laboratoire.
Des travaux anciens montrent que l’utilisation du β-carotène chez le rat est sensible à l’apport de vitamine E. Tandis qu’un apport normal de vitamine E stimule la conversion du β-carotène en vitamine A, des doses élevées de vitamine E réduisent significativement la quantité de vitamine A formée et stockée dans le foie (Johnson et Baumann, 1948). Cet effet est observé même lorsque le β-carotène est administré par voie intraveineuse avec l’α-tocophérol (McGilivray et Worker, 1958). Les doses élevées de vitamine C semblent aussi moduler l’utilisation du β-carotène (Mayfield et Roehm, 1956).
Interactions entre les vitamines C et E
Le stress oxydatif induit des dommages irréversibles dans les molécules telles que les lipides, les protéines et l’ADN. Il a été impliqué de ce fait dans la genèse de nombreuses maladies dites de civilisation (cancers, athérosclérose, diabète sucré, maladie d’Alzheimer…). De nombreuses études chez l’animal et chez l’homme ont mis en évidence un rôle protecteur des vitamines anti-oxydantes (C, E) et des caroténoïdes (en particulier le β-carotène). De ce fait, des essais randomisés ont été conduits afin de confirmer l’existence d’une relation de cause à effet. Malheureusement, les résultats de ces essais ont été le plus souvent négatifs ou ont montré que l’administration de doses élevées d’antioxydants pouvait favoriser le développement des pathologies qu’ils étaient supposés prévenir. Les résultats négatifs de ces essais ont été imputés aux types de sujets inclus (fumeurs, sujets exposés à l’amiante…) et à l’absence de prise en compte des synergies entre les différents antioxydants (vitamine C et vitamine E, par exemple). Il est en fait impossible de recréer dans les suppléments les nombreuses synergies existant dans les aliments. La synergie entre vitamine C et vitamine E est bien démontrée in vitro. Le mécanisme de cette synergie – la réduction des radicaux tocophéroxyles (α-TO•) par l’acide L-ascorbique pour régénérer l’α-tocophérol (figure 2) – a été mis en évidence à l’aide de la RPE (Niki et al., 1982) et de la radiolyse pulsée, soit en solution pure, soit dans des solutions contenant des liposomes. La
figure 3
représente l’oxydation en solution alcoolique du méthyl-linoléate initialisée par le 2,2’-azo-bis 2,4-diméthylvaléronitrile (AMVN). En l’absence d’antioxydant, l’oxydation du méthyl-linoléate est rapide (courbe 1). L’addition d’ascorbate (courbe 2) ou d’α-tocophérol (courbe 3) au milieu réactionnel ralentit significativement l’oxydation du méthyl-linoléate et une période de latence apparaît clairement. Lorsque le mélange ascorbate/tocophérol est ajouté à la solution alcoolique (courbe 4), la période de latence est encore plus longue (Niki et al., 1984). Les vitesses de consommation de l’ascorbate et de la vitamine E au cours de l’oxydation du méthyl-linoléate sont différentes. Lorsque l’ascorbate ou la vitamine E sont ajoutés à la solution éthanolique, leur concentration respective diminue linéairement avec le temps. En revanche, lorsqu’un mélange ascorbate/vitamine E est utilisé, l’ascorbate est d’abord consommé et l’α-tocophérol commence à être oxydé lorsque l’ascorbate est presque totalement oxydé (
figure 4
; Niki et al., 1984). Ces données montrent que l’α-tocophérol, en piégeant les radicaux peroxyles, est oxydé en radical tocophéroxyle (α-TO•) et que ce radical est immédiatement régénéré par l’ascorbate en α-tocophérol. Lorsque la totalité de l’ascorbate a été utilisée pour régénérer la forme radicalaire de la vitamine E, celle-ci ne peut plus être régénérée et sa concentration diminue progressivement. La synergie entre ascorbate et α-tocophérol a été aussi mise en évidence à l’aide de liposomes. Les liposomes constituent un milieu hétérogène dans lequel l’ascorbate, du fait de son caractère hydrosoluble, se répartit préférentiellement dans la phase aqueuse, et l’α-tocophérol, du fait de sa solubilité dans les phospholipides, se positionne préférentiellement à l’intérieur de la membrane. Ce modèle est plus intéressant, car plus proche des conditions in vivo. Lorsque les espèces radicalaires sont générées dans la phase aqueuse, la vitamine C ou la vitamine E inhibe le processus oxydatif – chaque vitamine induisant une période de latence différente (figure 5). En présence des deux vitamines, la durée de la période de latence est égale à la somme des durées de chaque période de latence (figure 5), l’effet est donc additif. Lorsque les espèces radicalaires sont initialisées à l’intérieur des membranes de phosphatidylcholine, l’ascorbate n’a plus d’effet direct. Cependant, lorsque l’α-tocophérol est inséré dans les membranes, l’ascorbate augmente la durée de la période de latence et l’effet est synergique. L’importance de la synergie entre la vitamine C et la vitamine E dépend de la chimie radicalaire de cette dernière. Le radical tocophéroxyle α-TO• formé lorsque la vitamine E neutralise les radicaux peroxyles LOO• générés dans la phase lipidique, peut réagir avec un autre radical péroxyle pour donner un produit stable (réaction 1), ou avec un radical tocophéroxyle pour donner un dimère (réaction 2) ou avec l’ascorbate (AH-) pour être régénéré en α-tocophérol, l’ascorbate étant oxydé en radical ascorbyle A-• (réaction 3) :
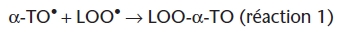
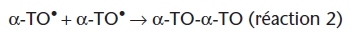

 |
Figure 2. Régénération de la vitamine E par l’acide ascorbique. |
 |
Figure 3. Inhibition de l’oxydation du méthyl linoléate en milieu alcoolique (alcool tert-butylique/méthanol; 3 :1; vol/vol) par la vitamine C et/ou la vitamine E (d’après Niki et al., 1984). |
 |
Figure 4. Consommation de la vitamine E (•) et de la vitamine C () au cours de l’oxydation du méthyl-linoléate à 27 ̊C dans le mélange alcool ter-butylique/méthanol (3:1, vol.vol) (d’après Niki et al., 1984). |
 |
Figure 5. Inhibition de l’oxydation des liposomes de phosphatidylcholine par la vitamine E, ou la vitamine C ou leur mélange. A) Oxydation générée par un générateur hydrosoluble d’espèces radicalaires introduit dans la phase aqueuse. B) Oxydation initialisée en phase lipidique par un générateur liposoluble incorporé dans les membranes liposomales. |
La régénération de la vitamine E est d’autant plus efficace que la concentration du radical peroxyle et/ou du radical tocophéroxyle est basse et que celle de l’ascorbate est élevée. L’efficacité de cette régénération dépend en fait principalement de l’accessibilité de l’ascorbate au radical tocophéroxyle. In vivo, la vitamine E serait régénérée à l’interface cytosol (phase aqueuse)/membrane cellulaire (bicouche de phospholipides) et l’interaction ascorbate/radical tocophéroxyle serait facilitée par le positionnement du noyau chromanoxyle à proximité de la surface de la membrane. Dans ce modèle, la queue phytyle du tocophérol est bien ancrée dans la double couche lipidique et le noyau chromanol « flotte » comme un cerf-volant au contact de l’interface phase aqueuse/phase lipidique afin de rendre accessible à l’ascorbate la fonction hydroxyle en position 6 du noyau chromanol qui est oxydé. Ces données expérimentales ont été reproduites ex vivo à l’aide de différents modèles cellulaires. En fait, la régénération de la vitamine E ne dépend pas que de l’ascorbate : le radical tocophéroxyle pourrait aussi arracher un électron à l’ubiquinol (coenzyme Q10) membranaire. De même, l’acide lipoïque, le glutathion et le β-carotène semblent interagir entre eux et avec la vitamine E afin de maintenir la constance de l’état redox cellulaire. Un schéma hypothétique a donc été proposé (figure 6). Ce schéma montre clairement la multiplicité et la complémentarité des mécanismes dont la cellule dispose pour lutter contre le stress oxydant. Il explique aussi les difficultés rencontrées pour mettre en évidence l’existence de ces synergies in vivo. De nombreuses études conduites chez l’animal ou chez l’homme étayent l’hypothèse de l’existence, in vivo, d’une synergie entre vitamine C et vitamine E. C’est ainsi qu’une « supplémentation » par la vitamine C induit une augmentation significative de la teneur des tissus en vitamine E chez le cobaye. À l’inverse, chez cet animal, une carence en vitamine C induit une diminution des teneurs tissulaires en vitamine E (Bertinato et al., 2007). Chez le rat Wistar ODS, qui a perdu la capacité de synthétiser la vitamine C, la teneur en vitamine E du plasma, du foie, du cerveau et du poumon est significativement plus élevée lorsque les animaux consomment un régime enrichi en vitamine C.
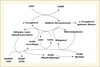 |
Figure 6. Régénération de la vitamine E à partir de sa forme radicalaire et synergies probables entre différents couples oxydoréducteurs : radical semidéhydroascorbate/ascorbate, NADPH/NADP, GSH/GSSG, ubiquinol/semiubiquinone, acide dihydrolipoïque/acide lipoïque. |
Chez l’homme, la capacité de la vitamine C à préserver la vitamine E a été démontrée chez les fumeurs (Bruno et al., 2006). L’administration par voie orale d’une dose élevée de vitamine C (0,5 g/j) chez des patients diabétiques induit une augmentation des concentrations sériques de vitamine C et de glutathion réduit et de la teneur des LDL en vitamine E mais n’a pas d’effet sur les marqueurs de la peroxydation lipidique et la susceptibilité des LDL à la peroxydation induite par radiolyse (Tessier et al., 2009).
L’athérosclérose représente une cause majeure de décès dans les pays industrialisés. Les données expérimentales suggèrent que l’oxydation des LDL constitue un processus important dans le développement de la plaque d’athérome. De ce fait, l’hypothèse que la diminution du stress oxydatif peut aider à prévenir la maladie ou à atténuer sa progression a été formulée. Si plusieurs études expérimentales ou essais cliniques montrent que les vitamines C et E ont un rôle protecteur, très peu d’essais randomisés ont mis en évidence un effet bénéfique de la vitamine E associée à la vitamine C vis-à-vis du risque de pathologies ischémiques. Cependant, trois essais randomisés récents utilisant des doses élevées des deux vitamines, dans des populations présentant un stress oxydatif important, montrent que celles-ci retardent le développement de l’artériosclérose (Boaz et al., 2000 ; Fang et al., 2002 ; Salonen et al., 2000). De même, chez des patients hypertendus, l’administration conjointe de vitamine C (1 g/j) et de vitamine E (400 IU/j) pendant 8 semaines est associée à une amélioration de la rigidité artérielle et de la fonction endothéliale (Plantinga et al., 2007), tandis que l’administration de vitamine E (1 000 UI/j), seule, pendant 10 semaines n’a aucun effet sur la fonction endothéliale d’adultes âgés (Simons et al. 1999). L’effet synergique bénéfique de l’administration de vitamine C et de vitamine E vis-à-vis de la fonction endothéliale dépend de plusieurs mécanismes. La vitamine E étant régénérée par la vitamine C, l’administration de vitamine C et de vitamine E contrecarre plus efficacement l’action délétère du stress oxydatif sur le NO. De plus, ces deux vitamines augmentent directement la production du NO (Heller et al., 2006) : d’une part, la vitamine C améliore la disponibilité de la tétrahydrobioptérine, le cofacteur de la NO synthase ; d’autre part, la vitamine C potentialise l’activation de la NO synthétase par l’α-tocophérol. Au total, ces deux vitamines agissent donc de manière synergique en optimisant la synthèse endothéliale du NO (Heller et al., 2006). Dans l’étude the Women’s Antioxidant Cardiovascular Study (WACS), les femmes dans le groupe « vitamine C + vitamine E » ont un risque d’accident vasculaire cérébral plus faible que les femmes du groupe placebo (RR = 0,69; IC à 95 % = 0,49-0,98, p = 0,04) (Cook et al., 2007).
Interactions entre β-carotène et vitamine E et autres micronutriments
À la fin du XXe siècle, les caroténoïdes, et en particulier le β-carotène, ont été l’objet d’un grand intérêt dans le domaine de la prévention du cancer, car de nombreuses études expérimentales montraient que le β-carotène joue un rôle protecteur vis-à-vis de la carcinogenèse et des enquêtes épidémiologiques tant prospectives que rétrospectives avaient mis en évidence une relation inverse entre la consommation de fruits et légumes colorés riches en caroténoïdes, ou les apports de β-carotène, ou les taux circulants de β-carotène d’une part et le risque de cancer, d’autre part. Malheureusement, peu d’études d’intervention ont confirmé ces données. Deux études d’intervention montrent en fait que le β-carotène augmente l’incidence du cancer du poumon chez les fumeurs ou les hommes ayant travaillé au contact de l’amiante (Étude CARET, Omenn et al., 1996 ; The Alpha-Tocopherol, Beta-Carotene Cancer Prevention study group, 1994). Plusieurs mécanismes ont été évoqués pour expliquer ces résultats. Les doses de β-carotène utilisées dans ces deux essais randomisés sont élevées (20-30 mg/j) et sont associées à des concentrations sériques très supérieures à celles mesurées dans la population non supplémentée (300 μg/dL pour l’étude ATBC, 210 μg/dL pour l’étude CARET et 20 à 100 μg/dL dans la population française non supplémentée). Les essais ont été conduits sur une durée courte tandis que les études d’observation ont évalué des apports habituels qui reflètent des habitudes alimentaires de plusieurs années. De plus, ces essais ont examiné les effets d’un seul nutriment tandis que les études épidémiologiques évaluent les effets du β-carotène apporté par des aliments contenant de nombreuses substances ayant un rôle protecteur potentiel. Il est probable que le potentiel « procarcinogène » du β-carotène soit du à son effet pro-oxydant. Les caroténoïdes neutralisent l’oxygène singulet 1O2 et les radicaux hydroperoxyles ROO. Le β-carotène (β-CAR) est particulièrement réactif vis-à-vis des radicaux hydroperoxyles en donnant un cation radicalaire (CAR•+) :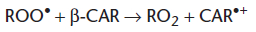
L’activité anti-oxydante des caroténoïdes est d’autant plus importante que la pression partielle de l’oxygène du milieu est basse. Lorsque la pression partielle en oxygène augmente, les caroténoïdes deviennent pro-oxydants. L’activité pro-oxydante du β-carotène a été mise en évidence dans de nombreux modèles cellulaires et pourrait être liée à une altération des défenses anti-oxydantes. Le traitement de cellules en culture par les caroténoïdes altère le métabolisme de la vitamine E. Lorsqu’un stress oxydatif est induit dans des membranes isolées ou des cellules entières, la diminution de leur teneur en vitamine E est plus importante en présence de β-carotène. Cependant, le β-carotène en présence d’autres antioxydants peut avoir un effet antioxydant. Dans les membranes cellulaires, l’effet inhibiteur du mélange β-carotène + α-tocophérol vis-à-vis de la lipoperoxydation est beaucoup plus important que la somme des effets inhibiteurs propres à chacun de ces deux antioxydants. Cette synergie s’exerce aux dépens de l’α-tocophérol. Dans un premier temps, celui-ci est consommé et retarde ainsi la formation des produits d’oxydation et d’auto-oxydation formés à partir du β-carotène. Le β-carotène induit la consommation de l’α-tocophérol dans les thymocytes isolés de souris et exposés à l’action du couple xanthine/xanthine oxydase. L’augmentation de la consommation de l’α-tocophérol en présence de β-carotène peut résulter de l’effet protecteur que le premier exerce vis-à-vis du second ; l’α-tocophérol, en bloquant l’oxydation du β-carotène et/ou en inhibant la formation des radicaux dérivés, serait oxydé. Le β-carotène module aussi la teneur en glutathion de cellules isolées. L’addition de β-carotène au milieu de culture de cellules leucémiques HL-60 entraîne une diminution de la concentration de glutathion réduit et une augmentation de la concentration de glutathion oxydé dans ces cellules. Les interactions du β-carotène avec les autres antioxydants semblent déterminer s’il a des effets antioxydants ou pro-oxydants. La présence d’autres antioxydants limite les effets pro-oxydants du β-carotène. Dans des membranes isolées, des concentrations élevées de β-carotène accélèrent le processus de lipoperoxydation, mais en présence de l’α-tocophérol cet effet n’est plus observé. Dans plusieurs lignées cellulaires tumorales, les effets pro-oxydants du β-carotène sont totalement supprimés par l’addition d’α-tocophérol. L’α-tocophérol bloque la production des espèces radicalaires dérivées de l’oxygène induite par le β-carotène dans les cellules d’adénocarcinome et les cellules HL-60.
Interactions entre vitamine E et vitamine K
Bien que l’existence d’interactions entre les vitamines E et K soit connue depuis plus de 50 ans, les mécanismes impliqués ne sont pas encore précisés. En 2000, le Food and Nutrition Board américain a fixé la limite de sécurité pour la vitamine E en se référant à des travaux chez le rat montrant que des doses élevées de vitamine E favorisent les hémorragies, un phénomène qui peut être annulé par l’administration de vitamine K (Wheldon et al., 1983). La consommation de suppléments de vitamine E diminue le risque de thrombose veineuse de 21 % dans l’étude the Women’s Health Study (Glynn et al., 2007) et inhibe la carboxylation de la prothrombine (Booth et al., 2004). L’essai randomisé avec placebo, the Women’s Health Study, a testé si la vitamine E (600 UI/j) peut prévenir les maladies cardiovasculaires ou le cancer chez environ 40 000 femmes américaines âgées de 45 ans ou plus. Les résultats montrent que la consommation de vitamine E pendant 10 ans n’a pas d’effet sur l’incidence du cancer, des maladies cardiovasculaires ou la mortalité globale mais diminue le taux de mortalité due aux pathologies cardiovasculaires de 24 %. La diminution de la mortalité cardiovasculaire chez les femmes traitées par la vitamine E a été attribuée à une diminution de l’incidence des morts subites, mais aucun mécanisme ne fut suggéré par les auteurs de l’étude. Cette diminution pourrait être due à un effet anticoagulant de la vitamine E, la consommation de suppléments contenant de la vitamine E étant associée à une réduction significative de l’incidence des thromboses veineuses (RR = 0,79; IC à 95 %, 0,66-0,94; p = 0,01) et à une incidence significativement plus importante des saignements de nez (RR = 1,06; IC à 95 %, 1,01-1,11; p = 0,02). La vitamine E pourrait avoir un effet anticoagulant en modulant le métabolisme de la vitamine K. Le terme « vitamine K » désigne trois substances liposolubles, dérivant du noyau 2-méthyl-1,4-naphtoquinone, la phylloquinone (vitamine K1), les ménaquinones (vitamine K2) et la ménadione (vitamine K3). La vitamine K1 constitue plus de 90 % de la vitamine K alimentaire, mais la principale forme présente dans les tissus chez l’homme est la ménaquinone-4 (MK-4). Les ménaquinones se distinguent de la vitamine K1 par leur chaîne latérale formée d’unités isoprényles en nombre variable (de 4 à 12). La vitamine K1 est convertie dans le foie en ménadione, qui est métabolisée en MK-4 dans les tissus extra-hépatiques (figure 7). Les vitamines K1 et MK-4 sont métabolisées, après ω- et β-oxydation de leur chaîne latérale, en 5C- et 7C-aglycones, qui sont excrétées après conjugaison dans la bile et les urines. Plusieurs hypothèses ont été évoquées quant aux mécanismes mis en jeu dans l’interaction entre la vitamine E et la vitamine K : (1) la vitamine E inhibe l’enzyme mise en jeu dans la coupure de la chaîne latérale de la phylloquinone pour conduire à la ménadione; (2) la vitamine E stimule les enzymes à cytochrome P450 impliquées dans le métabolisme et l’excrétion de toutes les formes de vitamine K; (3) la vitamine E entre en compétition avec la vitamine K1 vis-à-vis du cytochrome P450 qui « ω-oxyde » la chaîne latérale et inhibe de ce fait la β-oxydation de celle-ci en ménadione (figure 7). L’hypothèse que la vitamine E interfère avec la conversion de la vitamine K1 en MK-4 est supportée par l’observation que les concentrations extra-hépatiques de cette ménaquinone sont plus basses chez les rats consommant un régime enrichi en vitamine E (Tovar et al., 2006). Chez l’homme, la consommation d’une dose élevée de vitamine E (1 000 UI/j) est associée à une augmentation de la concentration de prothrombine anormale, peu ou pas carboxylée (PIVKA II, Protein Induced by Vitamin K Absence or antagonists) (Booth et al., 2004). De plus, l’expression du gène qui code le facteur de coagulation IX est régulée à la baisse par la vitamine E (Barella et al., 2004). La vitamine K intervient à la phase post-transcriptionnelle de la synthèse de plusieurs protéines de la coagulation, dont le facteur IX, par une réaction de carboxylation qui transforme des précurseurs inactifs en protéines fonctionnelles. La vitamine E bloque cette réaction de carboxylation ainsi que le montrent Tovar et al. (2006) chez le rat. Enfin, l’altération du pouvoir de coagulation du sang par la vitamine E peut être induite par l’effet de l’α-tocophérol sur les plaquettes. L’α-tocophérol inhibe l’agrégation plaquettaire (Steiner et Anastasi, 1976). Cependant, cet effet a été observé in vitro et en présence de doses pharmacologiques d’α-tocophérol. Ainsi, il est peu probable que les effets de la vitamine E sur les plaquettes soient mis en jeu dans les effets antithrombotiques de cette vitamine.
 |
Figure 7. Mécanismes hypothétiques impliqués dans les interactions entre la vitamine E et la vitamine K |
Conclusion
Les interactions entre les vitamines liposolubles A, D, E et K sont nombreuses, complexes et peu étudiées bien que leur description soit essentielle. De nombreuses études prospectives ont mis en évidence que les sujets consommant le plus de fruits et légumes ont un risque plus faible de développer un cancer ou une maladie cardiovasculaire tandis que les essais randomisés utilisant soit des antioxydants seuls soit un mélange complexe de plusieurs antioxydants (vitamines ou autres) ont rarement mis en évidence un effet bénéfique. Il est probable que la composition des suppléments utilisés dans ces essais ne reflète pas la totalité des interactions complexes existant entre les différentes substances, nutritionnelles ou non, présentes dans les produits végétaux. Il n’est pas possible d’étudier toutes les interactions existant entre les différentes substances présentes dans les aliments, qu’elles soient considérées ou non comme des nutriments. C’est ainsi que, classiquement, la régénération de la vitamine E est considérée comme dépendant de la vitamine C. Nous avons vu que celle-ci implique aussi l’acide lipoïque, le glutathion ; des travaux récents mettent aussi en évidence une synergie entre la vitamine E et les polyphénols présents dans le thé vert, ou les flavonols et leurs glycosides, ou le resvératrol et ses analogues. Il apparaît donc plus intéressant d’étudier les effets des différents aliments sur la santé et que les essais utilisant de suppléments constitués d’un mélange de plusieurs vitamines et nutriments ne pourront apporter des réponses adaptées.
Références
- Abawi FG, Sullivan TW. Interaction of vitamin A, D3, E and K in the diet of broiler chicks. Poult Sci 1989 ; 68 : 1490. [CrossRef] [PubMed] [Google Scholar]
- Albanes D, Virtamo J, Rautalahti M, et al. Serum β-carotene before and after β-carotene supplementation. Eur J Clin Nutr 1992 ; 46 : 559–566. [Google Scholar]
- Anderson LE, Myer RO, Brendemuhl JH, McDowell LR. The effect of excessive dietary vitamin A on performance and vitamin E status in swine fed diets varying in dietary vitamin E. J Anim Sci 1995 ; 73 : 1093–1098. [PubMed] [Google Scholar]
- Barella L, Muller PY, Schlachter M, et al. Identification of hepatic molecular mechanisms of action of alpha-tocopherol using global gene expression profile analysis in rats. Biochim Biophys Acta 2004 ; 1689 : 66–74. [CrossRef] [PubMed] [Google Scholar]
- Bertinato J, Hidiroglou N, Peace R, et al. Sparing effects of selenium and ascorbic acid on vitamin C and E in guinea pig tissues. Nutr J 2007 ; 6 : 7. [CrossRef] [PubMed] [Google Scholar]
- Blutt SE, Allegretto EA, Pike JW, Weigel NL. 1,25-dihydroxyvitamin D3 and 9-cis-retinoic acid act synergistically to inhibit the growth of LNCaP prostate cells and cause accumulation of cells in G1. Endocrinology 1997 ; 138 : 1491–1497. [CrossRef] [PubMed] [Google Scholar]
- Boaz M, Smetana S, Weinstein T, et al. Secondary Prevention with Antioxidants of Cardiovascular disease in Endstage renal disease (SPACE): randomized placebo-controlled trial. Lancet 2000 ; 356 : 1213–1218. [CrossRef] [PubMed] [Google Scholar]
- Booth SL, Golly I, Sacheck JM, et al. Effect of vitamin E supplementation on vitamin K status in adults with normal coagulation status. Am J Clin Nutr 2004 ; 80 : 143–148. [PubMed] [Google Scholar]
- Bruno RS, Leonard SW, Atkinson J, et al. Faster plasma vitamin E disappearance in smokers is normalized by vitamin C supplementation. Free Radical Biol Med 2006 ; 40 : 689–697. [CrossRef] [Google Scholar]
- Carlberg C, Bendik I, Wyss A, et al. Two nuclear signaling pathways for vitamin D. Nature 1993 ; 361 : 657–660. [CrossRef] [PubMed] [Google Scholar]
- Chlon TM, Taffany DA, Welsh JO, Rowling M. Retinoids modulate expression of the endocytic partners megalin, cubilin, and disabled-2 and uptake of vitamin D-binding protein in human mammary cells. J Nutr 2008 ; 138 : 1323–1328. [PubMed] [Google Scholar]
- Cook NR, Albert CM, Gaziano M, et al. A randomized factorial trial of vitamins C, E, and beta-carotene in the secondary prevention of cardiovascular events in women : results from the Women’s Antioxidant Cardiovascular Study (WACS). Arch Intern Med 2007 ; 167 : 1610–1618. [CrossRef] [PubMed] [Google Scholar]
- Fang JC, Kinlay S, Beltrame J, et al. Effects of vitamins C and E on the progression of transplant-associated arteriosclerosis : a randomised trial. Lancet 2002 ; 359 : 1108–1113. [CrossRef] [PubMed] [Google Scholar]
- Glynn RJ, Ridker PM, Goldhaber SZ, Zee RY, Buring JE. Effects of random allocation to vitamin E supplementation on the occurrence of venous thromboembolism : report from the Women’s Health Study. Circulation 2007 ; 116 : 1497–1503. [CrossRef] [PubMed] [Google Scholar]
- Goodman GE, Metch BJ, Omenn GS. The effect of long-term β-carotene and vitamin A administration on serum concentrations of α-tocopherol. Cancer Epidemiol Biomarkers Prev 1994 ; 3 : 429–432. [PubMed] [Google Scholar]
- Heller R, Werner-Felmayer G, Werner ER. Antioxidants and endothelial nitric oxide synthesis. Eur J Clin Pharmacol 2006 ; 62 (Suppl 13) : 21–28. [CrossRef] [Google Scholar]
- James SY, Mackay AG, Colston KW. Vitamin D derivatives in combination with 9-cis retinoic acid promote active cell death in breast cancer cells. J Mol Endocrinol 1995 ; 14 : 391–394. [CrossRef] [PubMed] [Google Scholar]
- Johnson RM, Baumann CA. The effect of alpha-tocopherol on the utilisation of carotene by the rat. J Biol Chem 1948 ; 175 : 811. [PubMed] [Google Scholar]
- Kane KF, Langman MJS, Williams GR. Antiproliferative responses of two human colon cancer cell lines to vitamin D3 are differentially modified by 9-cis-retinoic acid. Cancer Res 1996 ; 56 : 623–632. [PubMed] [Google Scholar]
- Kang S, Xiao-Yan I, Duell EJ, Duell EJ, Vorhees J. The retinoid X receptor agonist 9-cis retinoic acid and the 24-hydroxylase inhibitor ketoconazole increase activity of 1,25-dihydroxyvitamin D3 in human skin in vivo. J Invest Dermatol 1997 ; 108 : 513–518. [CrossRef] [PubMed] [Google Scholar]
- Kephart DD, Walfish PG, deLuca H, Butt TR. Retinoid X receptor isotype identity directs human vitamin D receptor heterodimer transactivation from the 24-hydroxylase vitamin D response elements in yeast. Mol Endocrinol 1995 ; 15 : 5858–5867. [Google Scholar]
- MacDonald PN, Dowd DR, Nakajima S, et al. Retinoid X receptors stimulate and 9-cis retinoic acid inhibits, 1,25-dihydroxyvitamin D3-activated expression of the rat osteocalcin gene. Mol Cell Biol 1993 ; 13 : 5907–5917. [PubMed] [Google Scholar]
- Mayfield HL, Roehm RR. The influence of ascorbic acid and the source of B vitamins on the utilization of carotene. J Nutr 1956 ; 58 : 203. [PubMed] [Google Scholar]
- McGilivray WA, Worker NA. The effect of tocopherol on the utilization of intravenously administered carotene. New Zealand J 1958 ; 1 : 273. [Google Scholar]
- McLaren DS. Influence of protein deficiency and sex on the development of ocular lesions and survival time of the vitamin A deficient rat. Br J Ophthalmol 1959 ; 43 : 234. [CrossRef] [PubMed] [Google Scholar]
- Moore T. The effect of vitamin E deficiency on vitamin A reserves of the rat. Biochem J 1940 ; 34 : 1321. [PubMed] [Google Scholar]
- Nakajima H, Kizaki M, Ueno H, et al. All-trans and 9-cis retinoic acid enhance differentiation of U937 cells. Leuk Res 1996 ; 20 : 665–676. [CrossRef] [PubMed] [Google Scholar]
- Nierenberg DW, Stukel TA, Mott LA, Greenberg ER. Steady-state serum concentration of α-tocopherol not altered by supplementation with oral β-carotene. J Natl Cancer Inst 1994 ; 86 : 117–120. [CrossRef] [PubMed] [Google Scholar]
- Niki E, Tsuchiya J, Tanimura R, Kamiya Y. Regeneration of vitamin E from alpha-chromanoxy radicals by glutathione and vitamin C. Chem Lett 1982 ; 789–792. [CrossRef] [Google Scholar]
- Niki E, Saito T, Kawakami A, Kamiya Y. Inhibition of oxidation of methyl linoleate in solution by vitamin E and vitamin C. J Biol Chem 1984 ; 259 : 4177–4182. [PubMed] [Google Scholar]
- Omenn GS, Goodman GE, Thornquist MD, et al. Effects a combination of β-carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med 1996 ; 334 : 1150–1155. [CrossRef] [PubMed] [Google Scholar]
- Plantinga Y, Ghiadoni L, Magagna A, et al. Supplementation with vitamins C and E improves arterial stiffness and endothelial function in essential hypertensive patients. Am J Hypertens 2007 ; 20 : 392–397. [CrossRef] [PubMed] [Google Scholar]
- Salonen JT, Nyyssonen K, Kaikkonen J, et al. Antioxidant supplementation in atherosclerotic prevention (ASAP) study : a randomized trial of the effect of vitamins E and C on 3-year progression of carotid atherosclerosis. J Intern Med 2000 ; 248 : 377–386. [CrossRef] [PubMed] [Google Scholar]
- Schrlsquäder M, Nayeri S, Kahlen JP, Müller KM, Carlberg C. Natural vitamin D3 response elements formed by vitamin D3 receptor-retinoid X receptor heterodimer-mediated transactivation. Mol Cell Biol 1995 ; 15 : 1154–1161. [PubMed] [Google Scholar]
- Segaert S, Garmyn M, Degreef H, Bouillon R. Retinoic acid modulates the anti-proliferative effect of 1,25-dihydroxyvitamin D3 in cultured human epidermal keratinocytes. J Invest Dermatol 1997 ; 109 : 46–54. [CrossRef] [PubMed] [Google Scholar]
- Shklar G, Schwartz J, Trickler D, Cheverie SR. The effectiveness of a mixture of β-carotene, α-tocopherol, glutathione, and ascorbic acid for cancer prevention. Nutr Cancer 1993 ; 20 : 145–151. [CrossRef] [PubMed] [Google Scholar]
- Simons LA, von Konigsmark M, Simons J, Stocker R, Celermajer DS. Vitamin E ingestion does not improve arterial endothelial dysfunction in older adults. Atherosclerosis 1999 ; 143 : 193–199. [CrossRef] [PubMed] [Google Scholar]
- Sklan D, Donoghue S. Vitamin E response to high dietary vitamin A in the chick. J Nutr 1982 ; 112 : 759. [PubMed] [Google Scholar]
- Steiner M, Anastasi J, Vitamin E. An inhibitor of the platelet release reaction. J Clin Invest 1976 ; 57 : 732–737. [CrossRef] [PubMed] [Google Scholar]
- Tessier DM, Khalil A, Trottier L, Fülöp T. Effects of vitamin C supplementation on antioxidants and lipid peroxidation markers in elderly subjects with type 2 diabetes. Arch Gerontol Geriatr 2009 ; 48 : 67–72. [CrossRef] [PubMed] [Google Scholar]
- The Alpha-Tocopherol, Beta-Carotene and Cancer Prevention Study group. Beta-Carotene and Cancer Prevention Study group The effect of vitamin E and beta-carotene on the incidence of lung cancer and other cancers in male smokers. N Engl J Med 1994 ; 330 : 1029–1035. [CrossRef] [PubMed] [Google Scholar]
- Tovar A, Ameho CK, Blumberg JB, Peterson JW, Smith D, Booth SL. Extrahepatic tissue concentrations of vitamin K are lower in rats fed a high vitamin E diet. Nutr Metab (Lond) 2006 ; 3 : 29. [CrossRef] [PubMed] [Google Scholar]
- Tsonis PA, Sargent MT, Del Rio-Tsonis K, Jung JC. 9-cis retinoic acid antagonizes the stimulatory effect of 1,25 dihydroxyvitamin D3 on chondrongenesis if chick limb bud mesenchymal cells : Interactions of their receptor. Int J Dev Biol 1996 ; 40 : 1053–1059. [PubMed] [Google Scholar]
- Wheldon GH, Bhatt A, Keller P, Hummler H. d, 1-Alpha-tocopheryl acetate (vitamin E): a long term toxicity and carcinogenicity study in rats. Int J Vitam Nutr Res 1983 ; 53 : 287–296. [PubMed] [Google Scholar]
- Willett WC, Stampfer MJ, Underwood BA, Taylor JO, Hennekens CH. Vitamins A, E and carotene : effects of supplementation on their plasma levels. Am J Clin Nutr 1983 ; 38 : 559–566. [PubMed] [Google Scholar]
- Xu MJ, Plezia PM, Alberts DS, et al. Reduction of plasma or skin α-tocopherol concentration with long-term oral administration of β-carotene in humans and mice. J Natl Cancer Inst 1992 ; 84 : 1559–1565. [CrossRef] [PubMed] [Google Scholar]
- Zugmaier G, Jlsquäger R, Grage B, Gottardis MM, Havemann K, Knabbe C. Growth-inhibitory effects of vitamin D analogues and retinoids on human pancreatic cells. Br J Cancer 1996 ; 73 : 1341–1346. [CrossRef] [PubMed] [Google Scholar]
Pour citer cet article : Guilland JC. Les interactions entre les vitamines A, D, E et K : synergie et/ou comp_etition. OCL 2011 ; 18(2) : 59–67. doi : 10.1051/ocl.2011.0376
Liste des tableaux
Effets de l’acide 9-cis rétinoïque sur la prolifération et la différenciation cellulaires, l’accumulation d’ARNm spécifiques et la transactivation par l’hétérodimère VDR-RXR.
Liste des figures
 |
Figure 1. Représentation schématique d’un effet additif et d’un effet synergique. |
| Dans le texte | |
 |
Figure 2. Régénération de la vitamine E par l’acide ascorbique. |
| Dans le texte | |
 |
Figure 3. Inhibition de l’oxydation du méthyl linoléate en milieu alcoolique (alcool tert-butylique/méthanol; 3 :1; vol/vol) par la vitamine C et/ou la vitamine E (d’après Niki et al., 1984). |
| Dans le texte | |
 |
Figure 4. Consommation de la vitamine E (•) et de la vitamine C () au cours de l’oxydation du méthyl-linoléate à 27 ̊C dans le mélange alcool ter-butylique/méthanol (3:1, vol.vol) (d’après Niki et al., 1984). |
| Dans le texte | |
 |
Figure 5. Inhibition de l’oxydation des liposomes de phosphatidylcholine par la vitamine E, ou la vitamine C ou leur mélange. A) Oxydation générée par un générateur hydrosoluble d’espèces radicalaires introduit dans la phase aqueuse. B) Oxydation initialisée en phase lipidique par un générateur liposoluble incorporé dans les membranes liposomales. |
| Dans le texte | |
 |
Figure 6. Régénération de la vitamine E à partir de sa forme radicalaire et synergies probables entre différents couples oxydoréducteurs : radical semidéhydroascorbate/ascorbate, NADPH/NADP, GSH/GSSG, ubiquinol/semiubiquinone, acide dihydrolipoïque/acide lipoïque. |
| Dans le texte | |
 |
Figure 7. Mécanismes hypothétiques impliqués dans les interactions entre la vitamine E et la vitamine K |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




